- COVID-19전세계 패닉을 몰고온 Coronavirus disease (COVID-19)는 과연 어디서 어떻게 시작된 것일까?
- COVID-19COVID-19 와 인체 감염의 현황
- COVID-19Corona pandemic시대에 RAS inhibitor를 사용해도 되는가?
- COVID-19COVID-19와 심혈관계 질환, 그것이 알고 싶다
- COVID-19COVID-19 창궐 동안 심도자실 운영은 어떻게?
- COVID-19COVID-19 창궐 동안 부정맥 검사실 및 시술은 어떻게?
- COVID-19코로나 바이러스 감염과 심부전
- 여성심장여성에서 심혈관 질환 위험성과 연관 있는 산부인과력을 간과하지 말자.
- 지질동맥Antisenseoligonucleotide (ASO) 인 APO(a)-LRx가 Lp(a) 가 높은 심혈관질환 환자에서 용량의존적으로 Lp(a)를 낮춰
- 중재술Type 2 MI or myocardial injury, Type I MI 보다 장기예후 나쁘다.
Corona pandemic시대에 RAS inhibitor를 사용해도 되는가?
To RAS or to not RAS in the COVID-19 era: That is the question.
2019년 12월부터 중국 우한에서 시작된 corona virus disease 2019(COVID-19) pandemic은 전세계로 급속히 퍼지면서 사회의 근간을 흔들 지경이 되었다. COVID-19은 경증의 상기도감염에서부터 중증의 급성폐손상까지 다양한 임상양상으로 나타나게 되는데 특히 고령자나 동반질환이 있는 사람들에서 중증의 폐손상과 높은 사망률이 보고되고 있다. 특히 고혈압과 당뇨의 동반율이 높다고 보고되고 있어 중증 COVID-19의 위험인자로서의 고혈압의 역할과 severe acute respiratory syndrome corona virus 2(SARS-CoV-2)의 수용체인 Angiotensin converting enzyme 2(ACE2)에 대한 관심이 높아지고 있다.1)2) 그렇지만 현재까지 보고된 논문들을 종합해보면 중증의 COVID-19환자들에서 고혈압의 유병률이 높은 것은 사실이나 중증 환자들의 연령도 유의하게 높기 때문에 연령을 고려한 고혈압의 유병률은 특별히 더 높지 않다는 것을 알 수 있고 아직까지 다변량 분석을 통해 고혈압이 중증 COVID-19감염증의 독립적 위험인자라고 발표된 논문은 한편도 없었다. Zhou등은 우한에서 진단된 191명의 환자들의 임상양상을 분석하였는데 이들 중 사망자(n=54)들의 평균연령은 69세였고 고혈압의 유병률은 48%로 통상적인 보고되는 60-70대 고혈압 유병률인 40-50%와 크게 다르지가 않았다.1) Guan등이 우한에서 진단된 1099명의 COVID-19환자들의 임상양상을 분석한 결과 중증환자들(N=173, 평균연령 52세)에서 고혈압의 유병률이 경증환자들(평균연령 45세)에 비해 높았지만(23.7% 대 13.4%) 이 또한 연령을 고려하면 크게 높지 않다는 것을 알 수 있다.2) 따라서 현재까지 보고된 연구결과들을 봤을 때 고혈압 자체가 COVID-19의 독립적 위험인자라고 할 만한 과학적 근거는 없다고 할 수 있다. 요약하면 중증의 COVID-19에서 고혈압의 유병률이 높아 보이는 이유는 첫째는 중증환자들의 연령이 높고 둘째는 만성심부전증, 뇌경색증, 만성신부전증과 같은 고혈압의 주요 합병질환에서 중증 COVID-19이 많이 발생하기 때문에 관찰되는 현상으로 생각된다.
Angiotensin converting enzyme(ACE2)가 corona virus의 수용체라는 것은 이미 2000년대 초에 SARS가 창궐할 때 밝혀졌었는데 당시 SARS는 pandemic수준까지 진행하지 않았기 때문에 위 사실은 큰 주목을 받지 못했었다.3)4) 그렇지만 최근에 COVID-19이 pandemic으로 진행하면서 다시 관심이 증폭되기 시작하였는데 최근 Science지에 Cov spike(S) glycoprotein의 주요 수용체가 ACE2이며 그 친화력은 SARS-CoV1보다 높은 것으로 보고되어 큰 논란이 되고 있다.5) 논란이 되는 주 이유는 앞서 언급된 것 처럼 중증의 COVID-19환자들에서 고혈압유병률이 높은데 고혈압 환자들에서 많이 사용되는 약제들인 RAS inhibitor(ACE inhibitor, angiotensin receptor blocker)가 이론적으로 ACE2를 상승시킬 수 있기 때문이다.
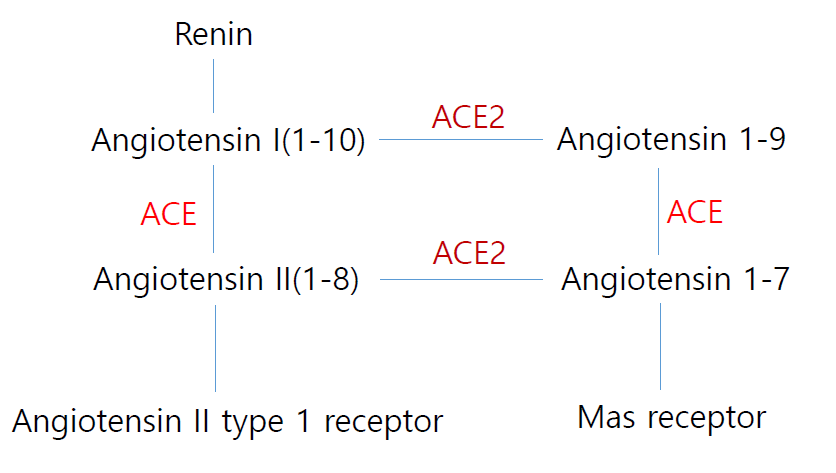
상기 그림을 보면 이해가 쉬운데 ACE inhibition을 투약하게 되면 Angiotensin I이 축적이 되어 ACE2가 활성화되는 것으로 보고 되고 있고 Angiotensin receptor blocker (ARB)를 투약하게 되면 Angiotensin I과 Angiotensin II가 축적이 되며 이 또한 ACE2의 활성화를 촉진시키는 것으로 보고되고 있다. ACE2가 활성화되면 Angiotensin II대신에 Angiotensin 1-7이 증가하게 되는데 Angiotensin 1-7은 수용체인 Mas receptor에 결합하여 혈관확장, 항산화, 항염증 작용을 촉진시켜 심혈관질환을 보호하는 효과가 있는 것으로 알려져 있다. 반면에 COVID-19 감염에 한정해서는 SARS-CoV-2의 수용체로서 COVID-19감염의 악화인자일 가능성이 제기되고 있고 이론적으로는 RAS inhibitor를 투약받는 사람들은 ACE2가 증가하기 때문에 ACE2를 수용체로 하는 SARS-CoV-2에 의한 COVID-19 감염에 상대적으로 더 취약할 수 있다. 특히 ACE2가 폐의 type II alveolar epithelial cell에서 많이 발현되기 때문에 중증의 COVID-19감염에 취약할 수 있다는 우려 때문에 복용하던 RAS inhibitor를 중단하거나 다른 약제로 변경하는 사례가 빈번히 보고되고 있어 전세계적으로 큰 논란이 되고 있다. 그러나 아직까지 이러한 조치를 취할 만한 과학적 근거가 없다고 할 수 있는데 첫째 RAS inhibitor를 투약한 후 혈중 ACE2 농도가 상승한다는 보고도 있지만 변화가 없다는 논문들도 있어 우리가 임상에서 사용하는 용량으로 혈중 ACE2가 유의한 변화가 있는지는 명확하지가 않다.6)7) 둘째는 ACE2는 SARS-Cov1의 수용체이기 때문에 RAS inhibitor가 corona 감염을 악화시킨다면 분명히 SARS의 유행 당시 RAS inhibitor를 투약받고 있는 환자들에서의 사망률 증가등이 보고됐어야 하는데 오히려 동물실험에서는 ACE2가 SARS에 의한 중증의 급성폐손상을 보호한다고 보고되었다. Imai등은 mice에서 위산 흡인을 통해 acute lung injury를 유도하여 실험을 진행하였는데 ACE knockout mice에서는 acute lung injury가 유의하게 억제되는 반면 ACE2 knockout mice에서는 wild type에 비해 acute lung injury가 악화되며 recombinant ACE2를 투여한 경우에는 유의하게 호전된다고 보고하였다.8) 또한 Kuba등은 mice SARS-CoV 모델로 실험을 진행하였는데 SARS-CoV의 spike protein은 ACE2에 부착되어 ACE2를 downregulation시키고 Angiotensin II를 활성화시켜 급성폐손상을 악화시켰고 ACE2 knockout mice에서 SARS-Cov를 감염시킨 결과 급성폐손상의 정도가 현저히 감소되는 것을 확인하여 ACE2가 SARS-Cov 감염에 따른 급성폐손상으로부터 보호하는 작용이 있음을 보고하였다.4) 위에 언급된 data들은 SARS 질환 모델에서 확인이 된 사실들로 같은 Corona virus 계열의 감염인 COVID-19또한 비슷한 병태생리기전을 보인다고 가정을 한다면 결국 ACE2는 급성폐손상으로부터 폐를 보호하는 효과가 있는데 Coronavirus는 ACE2에 부착되어 ACE2를 downregulation시킴으로써 급성폐손상을 악화시키는데 ACE inhibitor 나 ARB를 복용하고 있던 사람들은 혈중이나 폐의 ACE2가 증가되어 있어 이론적으로 중증 COVID-19감염의 위험이 감소된다고 할 수 있겠다.
결론적으로 1) 중증의 COVID-19 환자들에서 고혈압의 유병률이 높지만 이는 중증환자들의 연령이 많고 동반질환의 중증도가 높아서 보이는 현상으로 아직까지 고혈압이 독립적인 위험인자라는 과학적 증거는 없으며, 2) RAS inhibitor를 복용하면 혈중 및 폐의 ACE2가 증가할 수 있기 때문에 이론적으로는 중증 COVID-19 감염 증가의 우려가 있으나 아직까지는 임상적인 증거는 없고, 오히려 동물실험에서는 폐에서 ACE2가 증가 될수록 corona virus에 의한 급성폐손상이 감소된다는 결과들이 있어서 오히려 RAS inhibitor의 투약이 중증 COVID-19로부터 보호하는 효과가 있을 가능성이 있으며, 3) 고혈압이나 다른 심혈관질환으로 RAS inhibitor를 투약받고 있다가 변경을 할 경우 과도한 혈압의 상승이나 심혈관질환의 악화로 인한 위험이 오히려 더 높기 때문에 RAS inhibitor가 해롭다는 임상적 증거가 보고되기 전까지는 복용하고 있던 RAS inhibitor는 그대로 유지하고 기존처럼 RAS inhibitor를 처방해야 하는 환자들에서는 처방을 하는 것이 권장되며 이는 최근에 European society of Cardiology나 대한고혈압학회에서도 권고하는 임상지침이기도 하다.
참고문헌
 Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020. doi:10.1016/s0140-6736(20)30566-3.
Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020. doi:10.1016/s0140-6736(20)30566-3.
 Guan WJ, Ni ZY, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med 2020. doi:10.1056/NEJMoa2002032.
Guan WJ, Ni ZY, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med 2020. doi:10.1056/NEJMoa2002032.
 Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol 2004;203:631-7.
Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol 2004;203:631-7.
 Kuba K, Imai Y, Rao S, et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med 2005;11:875-9.
Kuba K, Imai Y, Rao S, et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med 2005;11:875-9.
 Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 2020;367:1260-3.
Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 2020;367:1260-3.
 Walters TE, Kalman JM, Patel SK, Mearns M, Velkoska E, Burrell LM. Angiotensin converting enzyme 2 activity and human atrial fibrillation: increased plasma angiotensin converting enzyme 2 activity is associated with atrial fibrillation and more advanced left atrial structural remodelling. Europace 2017;19:1280-7.
Walters TE, Kalman JM, Patel SK, Mearns M, Velkoska E, Burrell LM. Angiotensin converting enzyme 2 activity and human atrial fibrillation: increased plasma angiotensin converting enzyme 2 activity is associated with atrial fibrillation and more advanced left atrial structural remodelling. Europace 2017;19:1280-7.
 Burrell LM, Risvanis J, Kubota E, et al. Myocardial infarction increases ACE2 expression in rat and humans. Eur Heart J 2005;26:369-75; discussion 22-4.
Burrell LM, Risvanis J, Kubota E, et al. Myocardial infarction increases ACE2 expression in rat and humans. Eur Heart J 2005;26:369-75; discussion 22-4.
 Imai Y, Kuba K, Rao S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature 2005;436:112-6.
Imai Y, Kuba K, Rao S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature 2005;436:112-6.



