- 심부전 환자를 위한 RNA-based Therapy 최신 지견
- CHAP trial, 임신중 경증 고혈압의 목표 혈압은?
- IVVE trial: 심부전 환자에서 인플루엔자 백신을 접종할 경우 유행 시기에는 심혈관계 예후를 개선할 수 있다.
- 디지털 기술이 심부전 GDMT 개선시킬까?
- Myosin 억제제인 Mavacamten 은 좌심실 유출로 폐쇄를 동반한 비후성 심근증에서 중격 축소술을 지연시킬 수 있는가?
- 폐쇄성 비후성 심근증에서 Mavacamten은 장기적인 사용시에도 비교적 안전하게 효과가 지속된다.
- Factor XIa 억제제 아순덱시안은 아픽사반과 비교해 출혈 발생이 현저히 낮았다. -심방세동 환자 PACIFIC-AF 2상 결과
- 스마트폰을 기반으로 한 심방세동 환자의 스크린과 동반 질환의 역할
- ICD를 가지고 있는 환자에서 VT 발생 시 언제 전극도자절제술을 하는 것이 좋을까? – PARTITA trial 결과
- ANGPTL3를 표적으로 한 antisense 약제 vupanorsen, 좀 약했다.
- APOLLO 1상 임상연구/ 혈중 Lp(a) 농도를 낮추기 위해 siRNA 기반 LPA 유전자 발현억제제인 SLN360 피하주사는 이상 반응 없이, 농도 의존적으로 Lp(a)를 낮췄다.
- Noncardiac surgery시행시 tranexamic acid 투여는 출혈 예방에 효과적이다. (POISE-3 Trial)
- PerioOperative ISchemic Evaluation-3 Trial: Non cardiac surgery를 시행 받는 환자들에서 저혈압 방지 요법 대 고혈압 방지 요법의 무작위 배정 연구
- FLAVOUR: PCI에 풍미를 하나 더한다면 FFR이 좋을까? IVUS가 좋을까?
- ADAPT-TAVR Trial: TAVR 시행 후 에독사반 투약시 이중항혈소판제 투약과 비교하여 판막 혈전의 발생 빈도는 더 낮았지만 통계적 유의성은 없었고, 임상적인 이득 (뇌 혈전색전 및 신경인지 기능 변화) 또한 확인되지 않았다.
심부전 환자를 위한 RNA-based Therapy 최신 지견
RNA-Based Therapies for Dummies: Update for The Practicing Clinician
연구요약
심부전 환자에 대한 치료법은 상당히 발전되어 현재의 표준 치료법을 통해서도 환자 생존율은 많이 향상되었다. 그러나, Genetic cardiomyopathy (유전성 심근증)의 경우에는 심근경색증에 사용하는 일반 치료법을 적용하게 되면 실패하는 경우가 많다. 유전성 심근증의 특별한 pathophysiology를 무시하게 되면 적절한 치료법을 찾기가 어렵다. 특히, 어린 환자들의 경우에 표준 치료법으로는 치료하기가 까다로운 유전성 심근증이 많으며, 대표적인 것이 LMNA 또는 RBM20 돌연변이로 인해 발병되는 경우다.
암스테르담 심혈관연구소의 Yigal Pinto 박사는 RNA-binding motif protein 20 (RBM20) 돌연변이에 의해 발생하는 심부전에 관한 전문가이며, 이번 ACC 2022에서 RNA를 기반으로 한 심부전 치료에 관한 최신 지견을 보고하였다.
RBM20은 심장의 기능에 중요한 유전자인 Titin, CAMK2D (calcium/calmodulin-dependent kinase II delta)의 Splicing을 담당하는 단백질이다. RBM20 돌연변이를 가지고 있는 환자는 보통 어린 나이에 진단이 되며 심각한 dilated cardiomyopathy (DCM)을 가지고 있고, 높은 부정맥 발병 리스크로 인해 사망률이 높다. Pinto 박사는 RBM20 돌연변이 보인자 (Carrier)가 부정맥이 유발되는 기전을 규명하여 최근 Circulation에 보고하였다. 이 논문에서 RBM20 knockout 마우스는 심근세포의 칼슘 레벨을 조절하는 CAMK2D의 splicing이 제대로 되지 않아서 심근세포의 칼슘 과부하와 sarcoplasmic reticulum (SR)의 칼슘 농도가 높아져서 부정맥이 발생한다는 사실을 발견하였다. 이때 칼슘 차단제인 Verapamil을 주면 호전된다고 보고하였다 (1). 또한 RBM20는 Titin의 circular RNA (cTTN1)를 생산하는 역할을 하고, RBM20의 돌연변이는 cTTN1을 제대로 만들어 내지 못하게 된다. Circular RNA의 일반적인 기능은 아직 알려져 있지 않으나, microRNA를 흡수하여 그 기능을 교란하거나, RNA polymerase II와 직접 결합하여 transcription을 촉진하기도 하고, 단백질 합성에 대한 template로도 작용한다고 알려져 있다 (2). RBM20의 돌연변이를 교정하거나 정상적인 RNA를 공급해 준다면 치료가 가능할 것이다.
mRNA는 1961년 처음 발견된 이후로 여러가지 질병에 적용하기 위한 연구 주제가 되었으나, DNA보다 불안정한 성질 때문에 RNA의 구조와 기능을 규명하는 데 어려움을 겪었다. RNA를 기반으로 하는 약의 개발은 1990년 Wolff가 in vitro transcribed (IVT) mRNA를 마우스 골격근에 주입하여 근육에서 주입된 mRNA가 단백질로 번역된 것을 검증한 이후부터 본격적으로 시작되었다 (3). 특히, 암과 감염 질환에 대한 백신을 개발하기 위한 연구에 많은 관심이 집중되었다. mRNA는 DNA와 달리 핵으로 들어가지 않아도 세포질에서 단백질로 만들어 질 수 있다는 장점이 있으며, 게놈에 삽입되지 않고 완전히 분해되어 뒤따르는 돌연변이가 생길 염려가 없다. 그러므로 부작용이 최소화 될 수 있다. 게다가 생산 속도가 빠르고 비용이 저렴하기 때문에 상업화에 매우 유리하다 (4). 이러한 장점에도 불구하고 mRNA 백신이 상용화가 더딘 이유는 RNA가 불안정한 물질이기 때문에 저온 유통 되어야 하고, 인체에 들어가서 세포 내로 운반되기 위한 시스템에 대한 연구가 미흡했기 때문이다. 그러나 코로나로 인한 팬데믹 상황으로 인해 신속한 백신 개발이 절실해 졌고, 이는 mRNA 백신 개발과 승인에 박차를 가하게 되었다. 집중적인 투자와 연구를 통해, 위에 언급한 문제점들이 해소되어, 최초의 상용화 mRNA 백신이 2020년에 드디어 세상에 나오게 되었다.
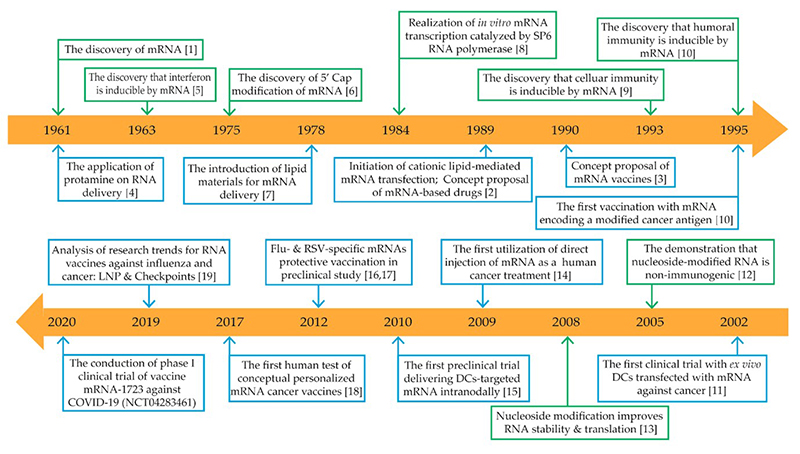 그림1. RNA 기반 치료제 개발 역사
그림1. RNA 기반 치료제 개발 역사
mRNA 기반 신약은 아직 상용화 된 것은 없으나 암 면역치료제 (Cancer immunotherapy), 재생의학 관련 치료제가 임상연구에 들어가 있다 (4).
| Phase | Method | mRNA encoding | Application |
|---|---|---|---|
| Clinical | Direct injection of mRNA | Melan-A, tyrosinase, gp100, MAGEA1, MAGEA3 and survivin MUC1, CEA, HER2, telomerase | Melanoma, renal cell carcinoma |
| Injection of DCs transfected ex vivo | PSA; telomerase; CEA; TriMix, MAGEA3, MAGEC2, gp100 tyrosinase; WT1 | Prostate cancer, pancreatic cancer, metastatic malignancies, colon cancer, melanoma, leukaemia | |
| Injection of T cell transfected ex vivo | CAR containing mesothelin-targeted antibody | Mesothelioma |
표1. 임상 시험에 적용된 mRNA 치료제
mRNA와 상보적으로 결합하여 단백질 생성을 억제하는 siRNA (short interfering RNA)의 임상 적용 시도가 활발하다. 2004년 siRNA를 이용한 최초의 임상시험을 시작으로 20종 이상의 siRNA 치료제가 임상 시험에 돌입하였다. 최초의 FDA 승인 치료제는 2018년에 승인된 transthyretin mediated amyloidosis에 대한 치료제였다. 현재는 안과 질환과 항암제에 관한 임상시험이 많으나, 콜레스테롤을 감소시키는 TKM-ApoB가 임상 1상까지 시도되는 등 심혈관 질환에 대한 RNA 치료제 개발도 계속 진행되고 있다.
Aptamer는 단백질과 결합하여 그 기능을 조절하는 핵산이다. 최근 개발되고 있는RNA aptamer는 항체보다 크기가 작고 생산 비용과 시간이 훨씬 적게 들기 때문에 항체를 대신하는 신약으로 개발하기 위한 연구가 각광받고 있다.
결론적으로, 팬데믹으로 인한 mRNA 백신 상용화는 지난 수십년간 연구되어온 RNA 기반 치료제의 상용화에 원동력이 되었고, 심혈관 질환에 대한 RNA 기반 치료제의 개발도 가속화 될 전망이다.
임상적 의의
유전성 심근증 등 유전자의 변이에 의한 심장질환은 심근경색에 대한 일반 치료법으로 접근하기보다는 유전자 치료제를 개발하고 적용하는 것이 필요해 보인다. 코로나 팬데믹으로 인하여 RNA 기반 치료제의 개발 속도가 빨라졌기 때문에 심혈관 질환 중 유전자 변이에 의한 질환의 치료제를 임상에 적용할 시기도 곧 도래할 것으로 예상된다.
참고문헌
1) Van den Hoogenhof MMG. et al. RBM20 Mutations Induce an Arrhythmogenic Dilated Cardiomyopathy Related to Disturbed Calcium Handling. Circulation 25;138(13):1330-1342 (2018).
2) Tijsen, A.J. et al. Titin Circular RNAs Create a Back-Splice Motif Essential for SRSF10 Splicing. Circulation 13;143(15):1502-1512 (2021).
3) Wolff, J. A. et al. Direct gene transfer into mouse muscle in vivo. Science 247, 1465–1468 (1990).
4) Sahin, U. et al. mRNA-based therapeutics — developing a new class of drugs. Nature reviews drug discovery 13, pages759–780 (2014)

